Injections d’insuline
Si vous avez récemment reçu un diagnostic de diabète, ou si vous connaissez quelqu’un qui l’a, vous avez probablement beaucoup de questions. Un grand nombre de ces questions auront reçu des réponses de la part de votre équipe soignante du diabète.
Certaines d’entre elles peuvent concerner un nouveau médicament qui vous a été prescrit, appelé insuline. L’insuline est un médicament couramment utilisé par les diabétiques pour leur permettre de traiter leur affection [1].
Cet article vous expliquera ce qu’est l’insuline, pourquoi vous en avez besoin et comment vous l’administrer par le biais d’injections d’insuline.
Qu’est-ce que l’insuline ?
L’insuline est une hormone fabriquée par des cellules spécialisées dans un organe appelé pancréas [1, 2]. L’insuline régule les taux de glycémie — elle est libérée dans votre circulation sanguine et agit sur les cellules dans tout votre organisme en leur permettant d’absorber le glucose de votre sang [1, 2]. L’insuline régule également l’utilisation des glucides, des lipides et des protéines [2].
L’insuline a été isolée et purifiée pour la première fois en 1921 [2]. Les scientifiques ayant mené les expériences qui ont prouvé que ce nouveau produit chimique pouvait abaisser les taux de glycémie ont remporté le prix Nobel de médecine en 1923 [2]. Vous pouvez en savoir plus sur la découverte de l’insuline dans notre brève histoire de l’insuline.
L’insuline est un médicament très fréquemment utilisé dans le monde entier. On estime que 150 à 200 millions de patients utilisent de l’insuline dans le monde [3].
Que sont les injections d’insuline ?
Des millions de personnes s’injectent de l’insuline chaque jour [4]. Contrairement à certains médicaments qui peuvent être pris sous forme de comprimés ou avalés sous forme liquide, l’insuline doit être administrée par voie sous-cutanée, intraveineuse et intramusculaire [1].
Les diabétiques administrent le plus souvent de l’insuline par voie sous-cutanée, en utilisant une aiguille fixée à une seringue ou un stylo à insuline pour injecter l’hormone sous la peau, ou en utilisant une pompe à insuline [1].
Quel type de diabète nécessite des injections d’insuline ?
Il existe différents types de diabète. Pour certains types de diabète, l’insulinothérapie est absolument vitale, tandis que d’autres peuvent ou non être traitées par insuline. Cela peut dépendre de facteurs tels que la façon dont l’affection a répondu à d’autres traitements, thérapies ou mesures préventives [1, 4].
Diabète de type 1
Dans le diabète de type 1, les cellules productrices d’insuline du pancréas sont détruites par le système immunitaire de l’organisme, un traumatisme ou une lésion du pancréas [1]. Cela entraîne un manque d’insuline qui ne peut être résolu qu’en remplaçant l’hormone de régulation de la glycémie par l’insulinothérapie.
L’insuline est toujours nécessaire dans le diabète de type 1 [1, 3]. Pour les personnes atteintes de diabète de type 1, l’insulinothérapie est essentielle [1].
Diabète de type 2
Dans le diabète de type 2, les cellules de l’organisme deviennent résistantes à l’insuline [1]. La cause exacte du diabète de type 2 est inconnue, mais des facteurs tels que la génétique ou l’obésité jouent un rôle. Le pancréas tente de contrer cette résistance en produisant de plus en plus d’insuline — cependant, cela finit par entraîner l’épuisement des cellules productrices d’insuline aux stades ultérieurs du diabète de type 2 [1].
L’insuline est parfois nécessaire pour le diabète de type 2. Il s’agit de l’un des nombreux traitements disponibles pour les personnes atteintes de diabète de type 2 [1, 3].
Diabète gestationnel
Le diabète gestationnel se développe pendant la grossesse. Il peut être traité par des modifications du régime alimentaire et de l’exercice, mais l’insuline peut être nécessaire si le régime alimentaire et l’exercice ne parviennent pas à contrôler la glycémie [1].
Diabète de type adulte chez le jeune (MODY)
Le diabète de type adulte chez le jeune (maturity onset diabetes of the young, MODY) est une maladie héréditaire dans laquelle une mutation génétique empêche les cellules pancréatiques de sécréter l’insuline correctement. Il peut être traité par des médicaments appelés sulfonylurées, mais l’insuline peut être nécessaire [1].
Quels types d’insuline existent ?
Les insulines peuvent être classées de différentes manières. L’une de ces façons est la vitesse à laquelle l’insuline agit une fois injectée [7] :
- Insuline à action rapide : action maximale en 30 minutes, dure 3 à 5 heures. Les insulines à action rapide sont généralement utilisées avant les repas et toujours parallèlement aux insulines à action brève ou prolongée tout au long de la journée pour gérer les taux de glycémie.
- Insuline à action brève : action maximale en 90 à 120 minutes, dure 6 à 8 heures. Ces insulines sont prises avant les repas. La nourriture est nécessaire dans les 30 minutes suivant son administration pour éviter une hypoglycémie.
- Insuline à action intermédiaire : action maximale en 4 à 8 heures. Elle aide à gérer les taux de glycémie tout au long de la journée et est généralement prise deux fois par jour.
- Insuline à action prolongée : agit sur 12 à 24 heures. La longue durée d’action de ces types d’insuline permet d’obtenir un effet plateau et de réduire la fréquence d’administration tout au long de la journée. Elle est généralement prise le soir, après les repas.
L’insuline est également disponible sous forme de mélange d’insuline à action rapide ou brève et d’insuline à action intermédiaire ou prolongée [5]. C’est ce qu’on appelle l’insuline prémélangée [5].
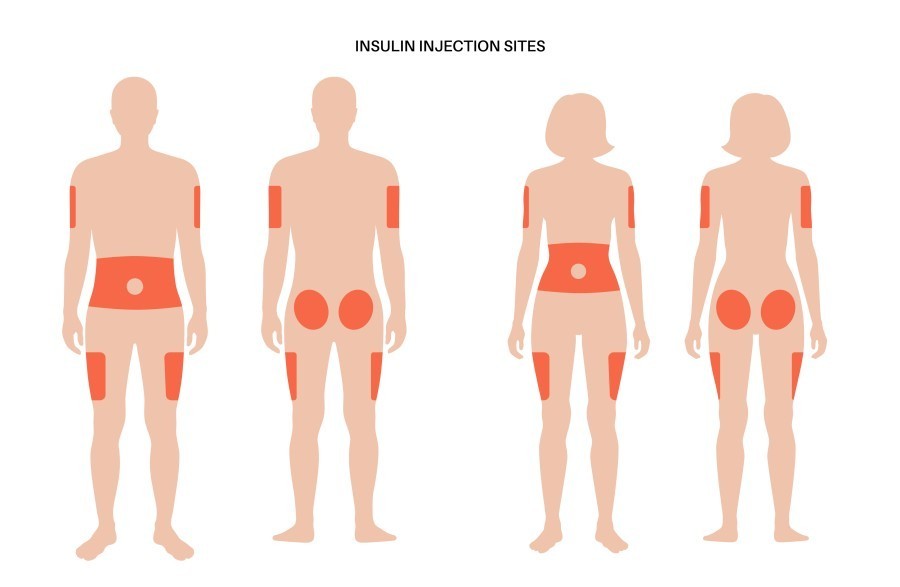
Où puis-je m’injecter de l’insuline ?
Où puis-je m’injecter de l’insuline ?
L’insuline est le plus souvent injectée dans la graisse sous-cutanée, juste sous la peau : on parle d’injection sous-cutanée [1, 4]. L’injection sous la peau est considérée comme plus facile et plus pratique que d’autres méthodes d’injection, comme par voie intraveineuse (dans une veine) ou intramusculaire (dans un muscle) [1].
Les sites recommandés pour l’injection d’insuline sont l’abdomen, les cuisses, les fesses et le haut des bras [4, 6].
Tous les sites ne sont pas adaptés à toutes les personnes qui doivent s’injecter de l’insuline. Par exemple, les injections abdominales ne conviennent pas aux personnes qui ne peuvent pas pincer 1,5 cm de graisse à injecter, comme les jeunes enfants ou les personnes musclées [4].
Une « rotation » des sites d’injection est également recommandée : autrement dit, il est conseillé de ne pas procéder à des injections répétées au même endroit, afin de réduire les complications pouvant survenir lors de l’injection, telles que la formation de cicatrices ou de dépôts graisseux [4, 6]. Cependant, il convient de noter que l’insuline est absorbée différemment selon les sites [4]. Il est donc conseillé de procéder à une rotation dans une zone définie [4].
Comment utiliser les injections d’insuline
Les injections d’insuline peuvent être administrées à l’aide d’une aiguille et d’une seringue [4, 6]. Elles peuvent également être faites à l’aide d’un dispositif appelé stylo à insuline qui fonctionne comme une seringue, mais qui contient l’insuline dans une cartouche préremplie [3].
Avant ouverture, les flacons et les stylos doivent être conservés au réfrigérateur [4]. Après ouverture, les stylos doivent être conservés à température ambiante, tandis que les flacons peuvent être conservés dans ou hors du réfrigérateur [4].
La technique d’injection d’insuline vous sera enseignée par votre équipe soignante. Cependant, elle prévoit généralement les étapes suivantes [4] :
- amorcez la seringue ou le stylo avec deux unités d’insuline ;
- en tenant la seringue verticalement avec l’aiguille pointée vers le haut, tapotez le corps de la seringue avec votre doigt pour expulser les bulles d’air, suivi de l’expulsion de deux unités supplémentaires d’insuline ;
- sélectionnez la dose réelle nécessaire ;
- choisissez votre site d’injection (comme le bras, l’abdomen, la cuisse ou une fesse) ;
- nettoyez la peau du site d’injection avec un tampon imbibé d’alcool ;
- pincez la peau entre le pouce et l’index, tournez légèrement pour vous assurer de ne pas serrer le muscle ;
- insérez l’aiguille à 45 degrés (ceci est approprié pour les zones où la graisse est moins importante, ce qui permet d’éviter une injection intramusculaire d’insuline). L’angle d’injection peut varier en fonction de la zone d’injection : un angle de 90° est approprié pour les zones présentant plus de graisse ;
- injectez l’insuline, puis desserrez les doigts avant de retirer l’aiguille ;
- après l’injection, exercez une légère pression pour minimiser les ecchymoses.
Votre équipe soignante vous expliquera comment utiliser correctement les injections d’insuline.
D’autres dispositifs peuvent être utilisés pour administrer l’insuline, notamment des pompes à insuline [3].
Effets secondaires de l’injection d’insuline
Chaque médicament peut avoir des effets secondaires, et l’insuline n’est pas différente.
Les effets secondaires des injections d’insuline peuvent être divisés entre les effets de l’insuline sur l’organisme et les effets de l’injection [1].
Les effets de l’insuline sur l’organisme peuvent inclure une hypoglycémie et une prise de poids [1]. Dans de rares cas, ils peuvent inclure des perturbations électrolytiques telles qu’une hypokaliémie [1].
Les effets secondaires de l’injection peuvent comprendre une douleur au niveau du site d’injection et une affection appelée lipodystrophie, qui provoque un perte de tissu cutané ou un gonflement de la peau [1, 4, 6].
Injections d’insuline : un résumé
Les injections d’insuline sont un traitement important pour les personnes diabétiques [1]. Votre équipe soignante vous apprendra comment gérer votre diabète à l’aide d’insuline et comment l’injecter correctement et efficacement.
Si vous souhaitez obtenir de plus amples informations sur l’insuline, les injections ou sur la gestion efficace de votre diabète, votre équipe soignante sera en mesure de vous orienter dans la bonne direction.
Sources :
- Thota S, Akbar A. “Insulin.” [Updated 2021 Jul 16]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 Jan-.
- Wilcox G. “Insulin and insulin resistance.” Clin Biochem Rev. 2005; 26(2):19-39.
- Buse JB, Davies MJ, Frier BM, et al. “100 years on: the impact of the discovery of insulin on clinical outcomes.” BMJ Open Diabetes Research and Care 2021; 9:e002373.
DOI: 10.1136/bmjdrc-2021-002373
- Dolinar, Richard. “The Importance of Good Insulin Injection Practices in Diabetes Management.” US Endocrinology, 2009; 5(1):49-52
DOI: 10.17925/USE.2009.05.1.49
- Kalra S, Czupryniak L, Kilov G, et al. “Expert Opinion: Patient Selection for Premixed Insulin Formulations in Diabetes Care.” Diabetes Ther. 2018; 9(6): 2185-2199. DOI:10.1007/s13300-018-0521-2
- Anders H. Frid, MD; Gillian Kreugel, DSN; Giorgio Grassi, MD; Serge Halimi, MD; Debbie Hicks, DSN; Laurence J. Hirsch, MD; Mike J. Smith, DSN; Regine Wellhoener, MD; Bruce W. Bode, MD; Irl B. Hirsch, MD; Sanjay Kalra, MD; Linong Ji, MD; and Kenneth W. Strauss, MD. “New Insulin Delivery Recommendations.” Mayo Clin Proc. n September 2016; 91(9):1231-1255
- O M Selivanova, S Yu Grishin, A V Glyakina, A S Sadgyan, N I Ushakova, O V Galzitskaya. Analysis of Insulin Analogs and the Strategy of Their Further Development. Biochemistry (Mosc). 2018 Jan;83(Suppl 1):S146-S162. doi: 10.1134/S0006297918140122
Show me:
All
419490419